
概念:
凡是來源于胚胎、組織器官及外周血,經特殊分離方法制備而來的原初培養的細胞稱之為原代細胞。原代細胞離體時間短且不經過永生化過程,其生物學特性未發生很大變化,仍保持原有的遺傳特征,可更好地反映細胞在體內的生長狀態,從而獲得與體內生理功能更接近的數據,很適合用于藥物測試、細胞分化和轉化等實驗研究。
原理介紹:
原代細胞的分離是將人/小鼠等特異模式動物的細胞從機體中取出,經胰酶、螯合劑(常用EDTA)處理,分散成單細胞,置合適的培養基中培養,使細胞得以生存、生長和繁殖的過程。 原代培養是指直接從機體取下細胞、組織和器官后立即進行培養。因此,較為嚴格地說是指成功傳代之前的培養,此時的細胞保持原有細胞的基本性質,如果是正常細胞,仍然保留二倍體數。但實際上,通常把第一代至第十代以內的培養細胞統稱為原代細胞培養。最常用的原代培養有組織塊培養和分散細胞培養 。
實驗方法:
一、懸浮細胞的分離方法
組織材料若來自血液、 羊水、胸水或腹水的懸液材料, 最簡單的方法是采用 1000r/min 的低速離心 10 分鐘,若懸液量大,可適當延長離心時間,但速度不能太高,延時也不能太長,以避免擠壓或機械損傷細胞,離心沉淀用無鈣、鎂 PBS 洗兩次,用培養基洗一次后,調整適當細胞濃度后再分瓶培養,若選用懸液中某些細胞,常采用離心后的細胞分層液,因為,經離心后由于各種細胞的比重不同可在分層液中形成不同層,這樣可根據需要收獲目的細胞。
二、實體組織材料的分離方法
對于實體組織材料,由于細胞間結合緊密,為了使組織中的細胞充分分散,形成細胞懸液,可采用機械分散法(物理裂解)和消化分離法。其中,機械分散法的特點是簡便、快速,但對組織機械損傷大,而且細胞分散效果差,適用于處理纖維成分少的軟組織。消化分離法是指把組織剪切成較小團塊(或糊狀),應用酶的生化作用和非酶的化學作用進一步使細胞間的橋連結構松動,使團塊膨松,由塊狀變成絮狀,此時再采用機械法,用吸管吹打分散或電磁攪拌或在搖珠瓶中振蕩,使細胞團塊得以較充分的分散,制成少量細胞群團和大量單個細胞的細胞懸液,接種培養后,細胞容易貼壁生長。
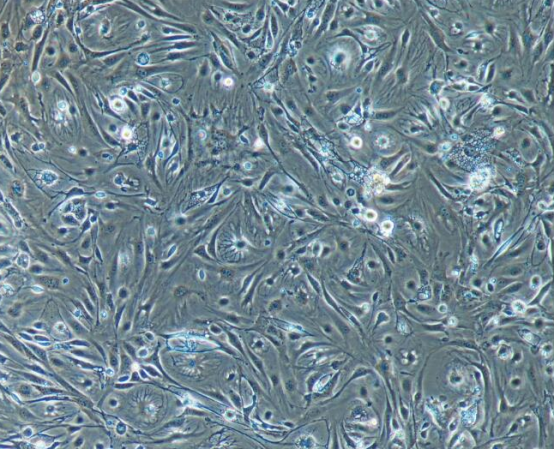
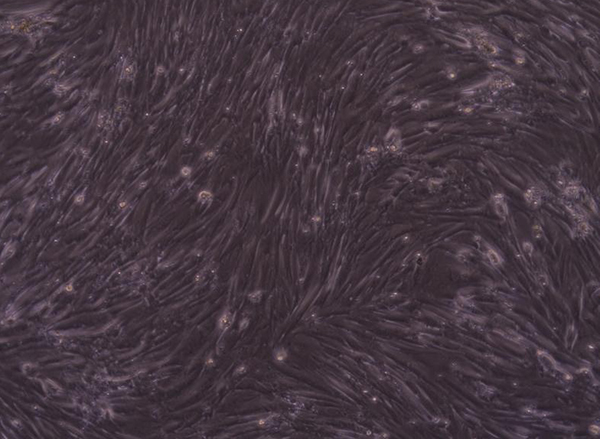
三、小鼠肝細胞原代培養
1、取肝臟:將小鼠斷頸致死,取肝臟;
2、除雜物:剔除脂肪、結締組織、血液等雜物;
3、研磨肝臟:用手術剪將臟器剪成小塊并研磨;
4、胰酶消化:加入胰酶消化,使細胞分離;
5、濾網去雜:用濾網過濾,除去大組織塊;
6、細胞計數:血球計數板計數。
原代培養注意事項:
(1)原代培養材料的選擇,盡量選取繁殖能力較強的組織,如胚胎、幼小的生物體或者腫瘤組織等。
(2)樣本必須為無菌采取完整的組織塊,新鮮組織離體后置于無菌培養基中,冰袋運輸。離體時間不可超過4小時。
(3)整個取材操作要迅速,尤其孕鼠浸泡乙醇時間1min左右,不能過長,以確保胚胎細胞活性。
(4)運用消化法時胰酶溫度應低于37℃,濃度只需平時消化細胞濃度的一半。因為此過程不像消化培養細胞時的1~10min,而是至少20min,先消化下來的細胞在此胰酶消化液中繼續消化了10min以上。所以胰酶不能作用過強,否則這些細胞易被損傷而不易生存。
(5)如使用組織塊法,則應待組織塊略干燥,能黏附于瓶壁時再使之與培養液接觸,匆使組織塊漂浮起來。如果組織塊沒有黏壁,則細胞不易生長,即使生長也因沒有貼在瓶壁上,從而因不能觀察到而無法收集到生長的細胞。
(6)原代培養操作時,也可以使用未添加血清的DMEM或PBS洗滌子宮、胚胎或組織塊等。
(7)本實驗也可以使用新生乳鼠做培養材料。此時要將乳鼠浸入75%乙醇2~3min使皮膚充分消毒,由于乳鼠原代培養污染概率更高,故應小心操作,避免污染細菌。乳鼠原代培養細胞的存活率不及胚胎細胞培養的成功率。
案例展示:

科研服務咨詢

公眾號二維碼