
免疫熒光技術(immunofluorescence technique)是在免疫學、生物化學與顯微鏡技術的基礎上建立起來的一項技術。用熒光抗體示蹤或檢查相應抗原的方法稱為熒光抗體法;用已知的熒光抗原標記物示蹤或檢查相應抗體的方法,稱為熒光抗原法。這兩種方法總稱為免疫熒光技術。但實際工作中熒光抗原技術應用很少,所以常將熒光抗體技術稱為免疫熒光技術。
熒光單標:
在一張切片上對一個抗原進行標記,即為免疫熒光IF單標,可直接在組織切片、細胞涂片或培養細胞爬片上原位顯示某些蛋白質或多肽類物質,通常可標記紅光或綠光,細胞核用DAPI標記。
熒光雙標:
在一張切片上對兩個抗原進行標記,即為免疫熒光IF雙標,可直接在組織切片、細胞涂片或培養細胞爬片上原位顯示某些蛋白質或多肽類物質,普通方法免疫熒光雙標要求一抗來源不能相同,若是相同,二抗無法區分。不同的一抗對應標記不同顏色,可以用于定位兩種不同的抗原。
熒光三標:
在一張切片上對三個抗原進行標記,即為免疫熒光IF三標,可直接在組織切片、細胞涂片或培養細胞爬片上原位顯示某些蛋白質或多肽類物質,普通方法免疫熒光三標要求一抗來源不能相同,若是相同,二抗無法區分。不同的一抗對應標記不同顏色,可以用于定位三種不同的抗原。
免疫熒光染色及成像分析是研究組織形態和組織原位抗原表達不可或缺的檢測技術,廣泛應用于臨床病理和醫學及生物學研究的各個領域。凡是可以作為抗原或半抗原的物質,如:蛋白質、多肽、氨基酸、多糖、磷脂、酶、激素、病原體及受體等,都可以在細胞、亞細胞水平檢測到。
免疫熒光技術根據抗原抗體特異性結合的原理,先將已知抗體(或抗原)標記上熒光基團,再利用這種熒光抗體(或抗原)作為探針來檢測固定細胞或組織內的相應抗原(或抗體)。在熒光顯微鏡下觀察,當抗原抗體復合物中的熒光素受激發光照射后,會發射出一定波長的熒光,從而確定靶抗原(或抗體)的性質與定位,還可利用定量技術(如:流式細胞儀)測定含量。
脫蠟與水化-抗原修復-血清封閉-孵育一抗-孵育二抗-DAPI染核-封片-顯微鏡鏡檢。
1、提供固定合格的樣本。組織離體后,選擇合適的固定液立即固定,固定液的量建議大于組織體積的10-15倍,新鮮標本用合適的容器固定24-48h,大標本固定12h,再切開固定。標本常溫(24℃左右)或冷藏(4℃)固定,切勿冷凍結冰,固定樣本常溫運輸送樣。
2、涂片和爬片必須充分固定,石蠟切片實驗前需充分脫蠟。
3、提供準確的抗體信息。
結果示例:
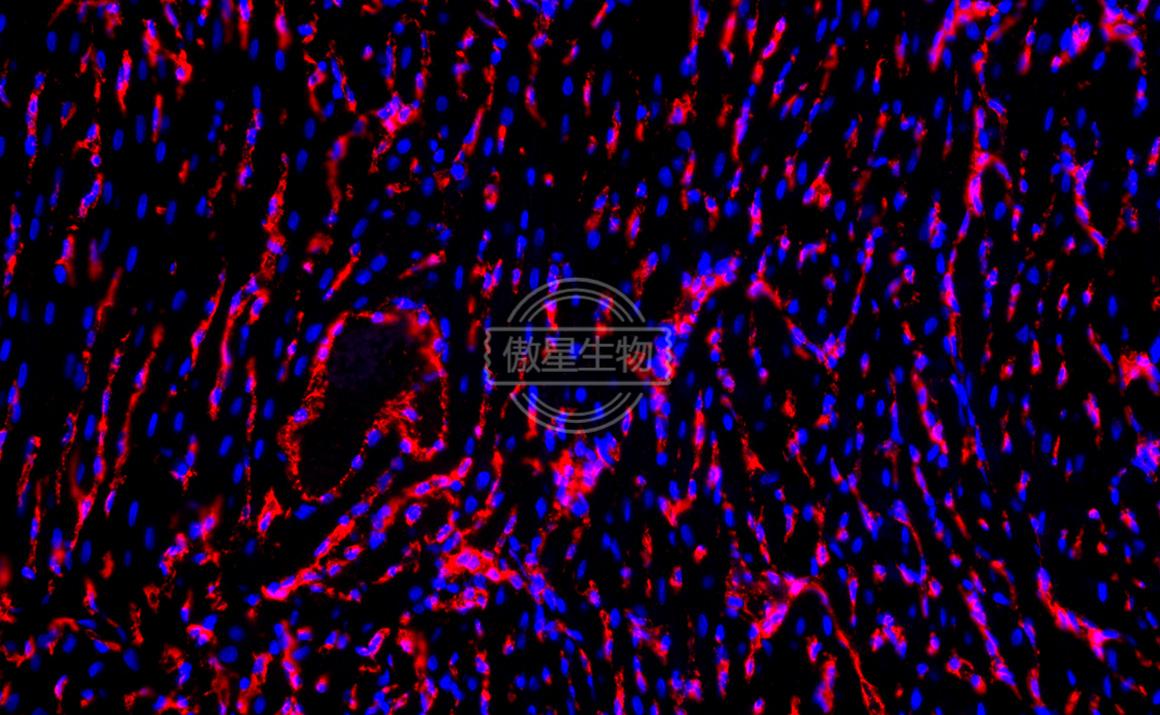
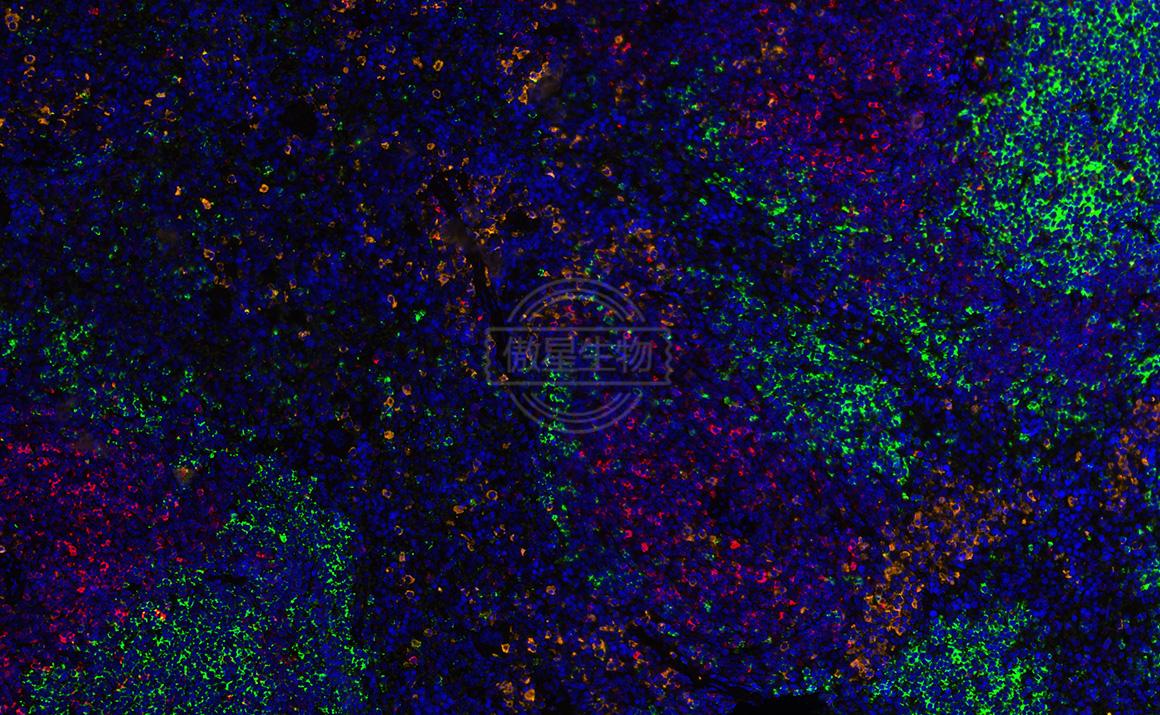
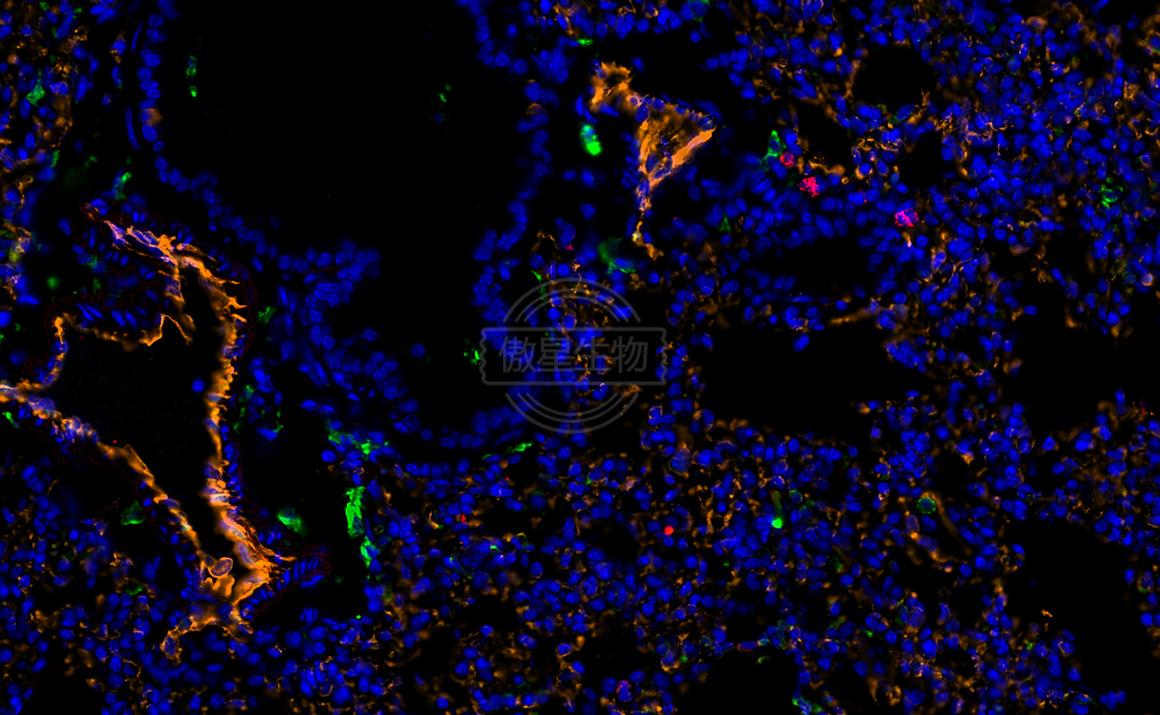

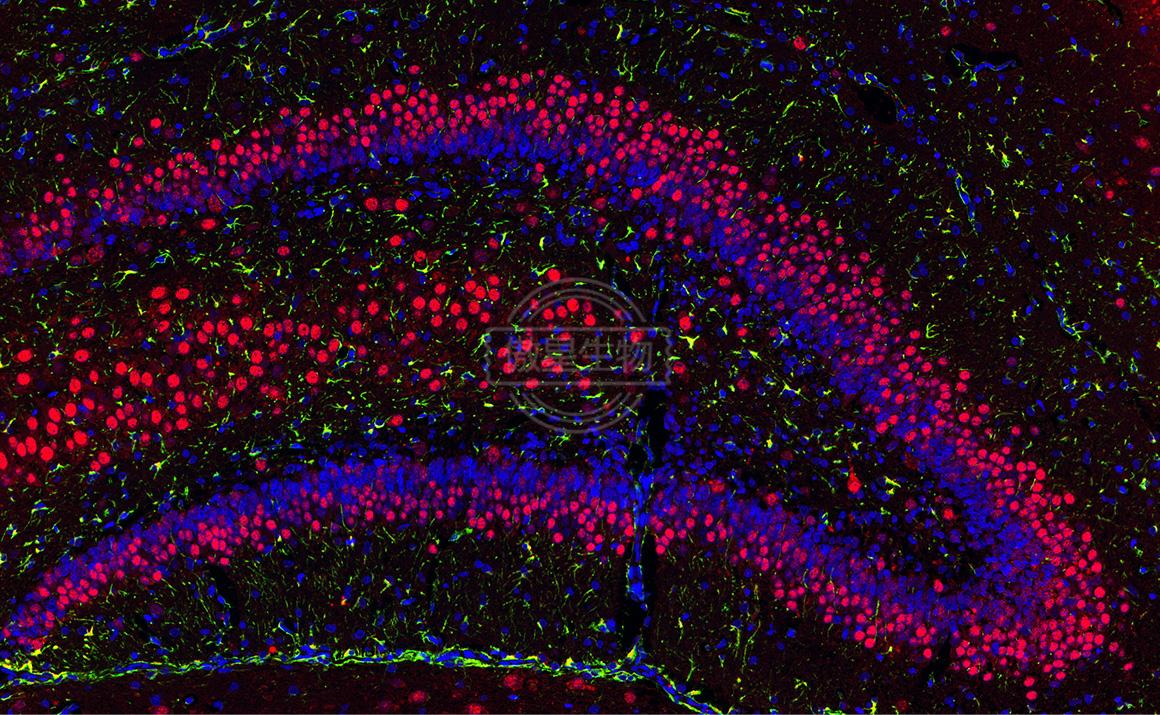
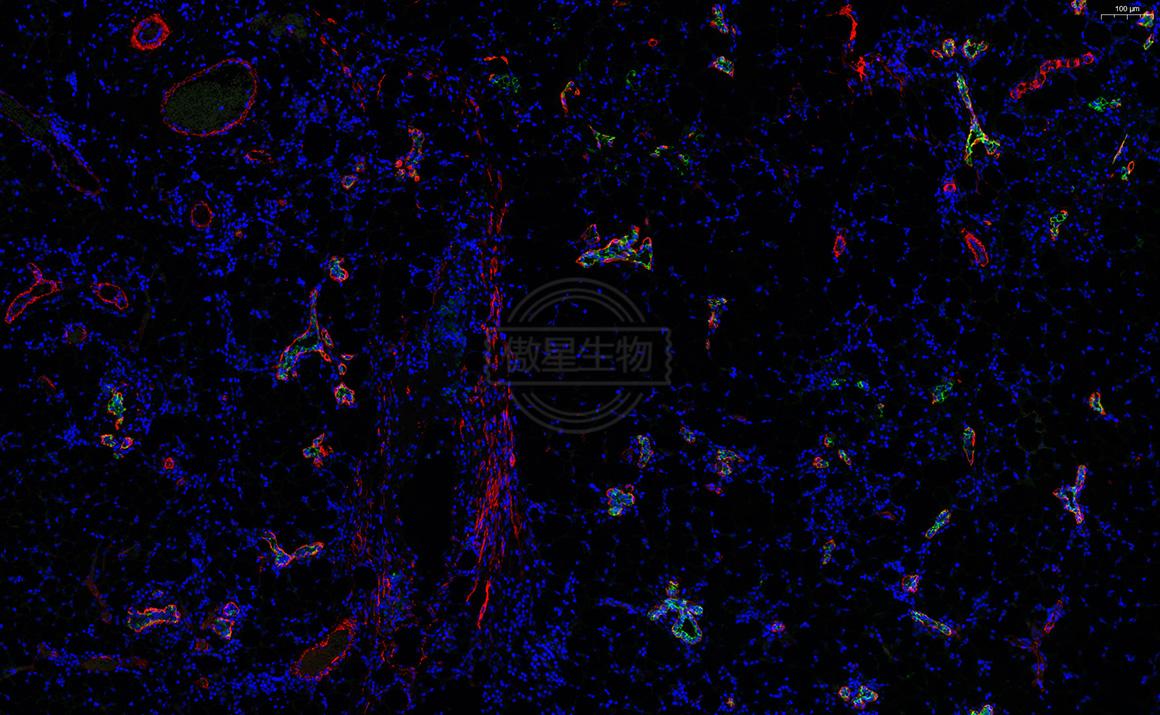
實驗常見問題解答:
1、為什么背景染色較深?
1)抗體濃度過高:一抗濃度過高是常見的原因之一。解決辦法是,每次使用新抗體前應當對其工作濃度進行測試,使每一抗體個體化,找到適合自己實驗室的理想工作濃度,既使是即用型的抗體也應如此,不能只簡單的按說明書進行染色。
2)抗體孵育時間過長或溫度較高:解決辦法是,嚴格執行操作規程,更好隨身佩帶報時表或報時鐘,及時提醒,避免因遺忘而造成時間延長。現在流行的二步法(Polymer)敏感性很高,要求一抗孵育的時間不是傳統的1小時,而是30分鐘,因此,要根據染色結果進行調整。
3)DAB變質和顯色時間太長:DAB更好現用現配,如有沉渣應進行過濾后再用。配制好的DAB不應存放時間太長,因為在沒有酶的情況下,過氧化氫也會游離出氧原子與DAB產生反應而降低DAB的效力,未用完的DAB存放在冰箱里幾天后再用這種似乎節約的辦法是不可取的。DAB的顯色更好在顯微鏡下監控,達到理想的染色程度時立即終止反應。不過當染色片太多時或用染色機時,這樣做似乎不現實,但至少應對一些新的或少用的抗體顯色時進行監控,避免顯色時間過長。
4)組織變干:修復液溢出后未及時補充液體、染色切片太多、動作太慢、忘記滴液、滴液流失等都是造成組織變干的原因。解決的辦法是操作要認真仔細,采用DAKO筆或PAPPen在組織周圍畫圈,可以有效的避免液體流失,也能提高操作速度。
5)切片在緩沖液或修復液中浸泡時間太長(大于24小時):原因上不清楚,但現象存在。有的實驗室喜歡前將切片脫蠟至修復,第二天加抗體進行免疫組化染色,如果將裝有切片和修復液的容器放在4oC冰箱過夜,對結果無明顯影響,如果放在室溫,特別是炎熱的夏天,會出現背景著色,因此,不可存放時間太長。
6)一抗變質、質量差的多克隆抗體:注意抗體的有效期,過期的抗體要么不顯色要么背景著色。用新買抗體時更好設立陽性對照和用使用過的抗體作比較。
2、為什么定位不準確?
1)細胞核干擾:細胞核位置前面的細胞質染色干擾造成,可以降低抗體濃度,孵育時間
2)細胞或者組織狀態不對:細胞或者組織狀態不同導致你的目的蛋白細胞定位不同,造成最后的定位不對,如果一直出現定位不對問題,建議重新培養細胞調整好狀態或者重新取材,進行再次染色。
3)共定位問題解析:假設想證明某一細胞發生某種變化,換句話說就是既有某種蛋白表達,又有另一種蛋白表達,兩種蛋白屬于共定位,該種情況可以采用免疫雙標記檢測;如果兩種蛋白不屬于共定位,假設一種在膜上表達,一種在胞漿表達,該種情況應該不屬于共定位,屬于共表達,這時候實驗應該重新設計去驗證你的結論。
4)核定位不對:核內表達的抗原定位用免疫熒光或者免疫酶標都可以。如果定位不正確,建議封閉和打孔合為一步,即在封閉液中添加0.5% TRITON-100,37度封閉2小時,加一抗后最好4度孵育過夜(16小時)。

科研服務咨詢

公眾號二維碼